本月份,J Control Release连续上线郭志德老师团队的两篇文章,介绍了4-(对碘苯基)丁酸(IPBA)基团在放射性探针设计方面的研究进展。
在分子影像与靶向核素治疗领域,如何优化放射性药物的血液半衰期是提升诊疗效果的关键。成像探针的快速血液清除虽有利于提高肿瘤靶向对比度,但可能限制治疗性核素在肿瘤中的富集。为此,团队将目光聚焦于白蛋白结合基团(ABM)的修饰策略。其中,4-(对碘苯基)丁酸(IPBA)因其独特的白蛋白结合特性及灵活的修饰位点,成为放射性药物设计的明星分子。近年来,基于IPBA的放射性配体设计在分子影像和靶向放射性核素治疗(TRT)中取得了重要进展,但其结构优化和临床转化仍面临挑战。
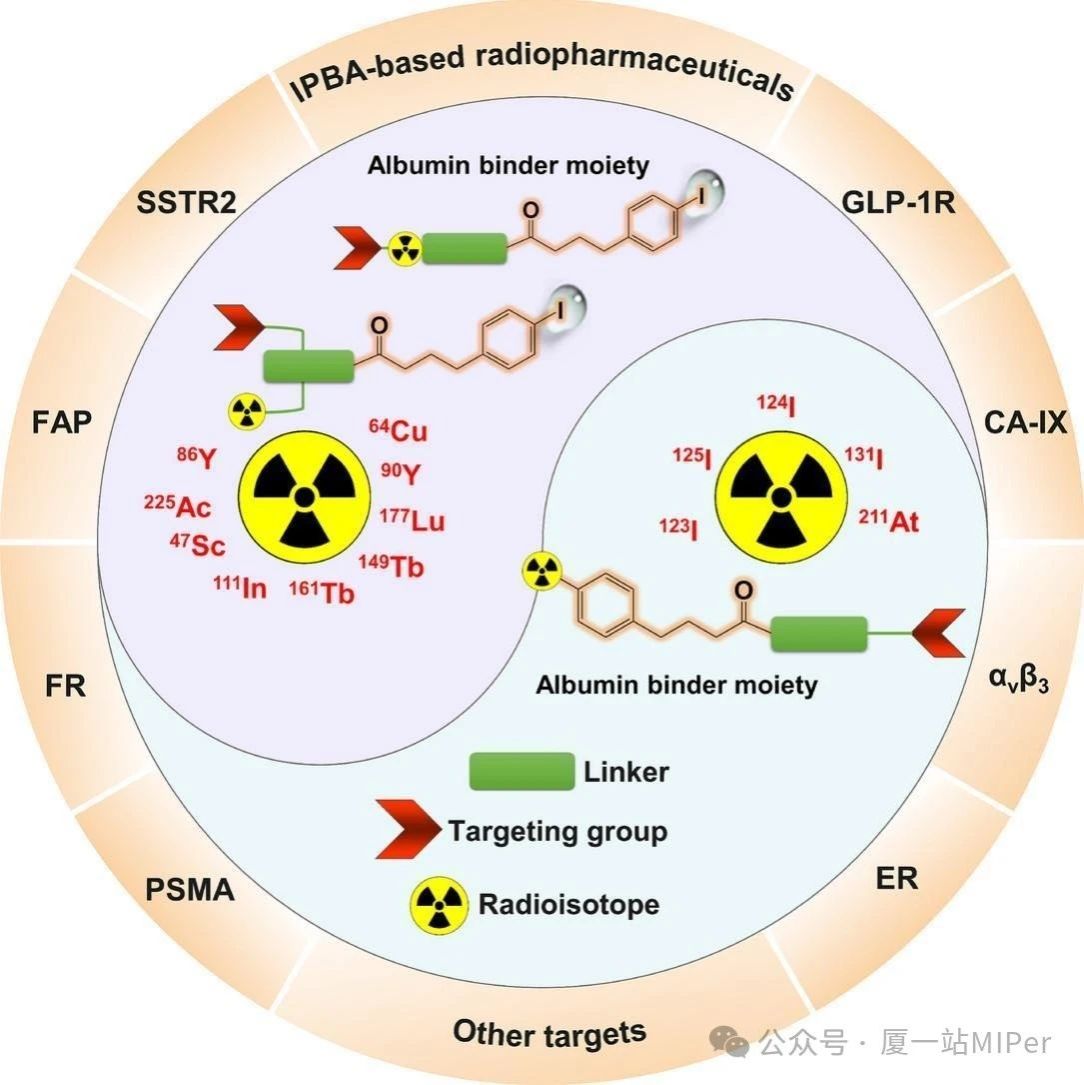
在题为“Development of Radioligands with an Albumin-Binding Moiety of 4-(P-Iodophenyl) Butyric Acid for Theranostic Applications” 的综述文章中,其系统总结了IPBA修饰的小分子放射性配体的最新进展。IPBA通过结合血清白蛋白显著延长药物血液循环时间,同时支持承载多种放射性核素(如放射性碘家族、砹-211等),实现诊疗一体化。此外,IPBA衍生物可通过调节苯环对位取代基(如Br、Cl、CH₃等)和连接臂长度,调控药物动力学特性,平衡肿瘤靶向与背景清除效率。目前,IPBA技术已成功应用于叶酸受体(FR)、前列腺特异性膜抗原(PSMA)、成纤维细胞激活蛋白(FAP)等多种靶点的放射性配体开发,显著提升肿瘤摄取与滞留效果。
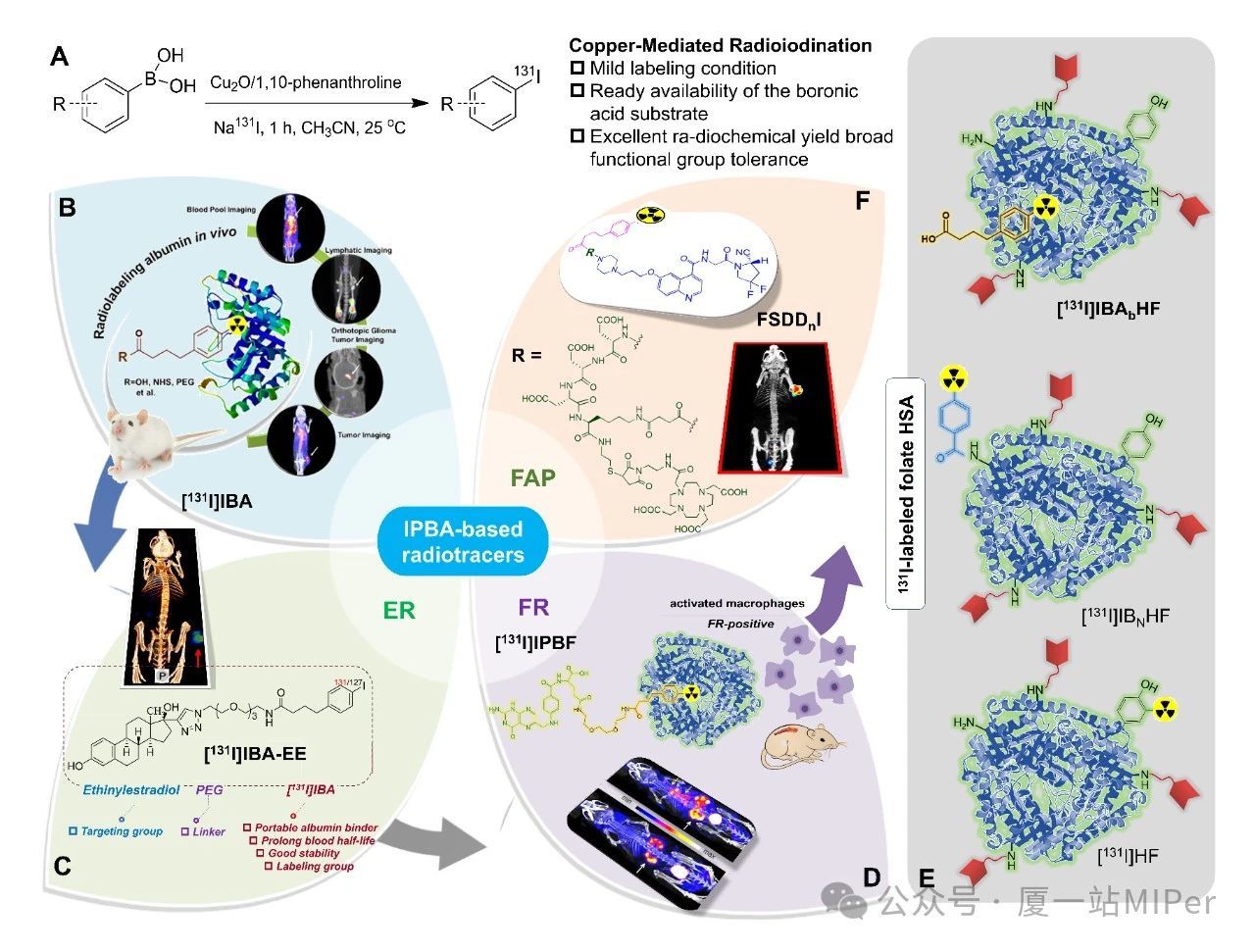
综述同时系统介绍了团队在IPBA修饰的放射性探针递送领域的研究成果(如铜催化的放射性碘标记策略,涵盖FAP、叶酸受体和雌激素受体等靶点探针),为诊疗型放射性配体的理性设计提供了参考。
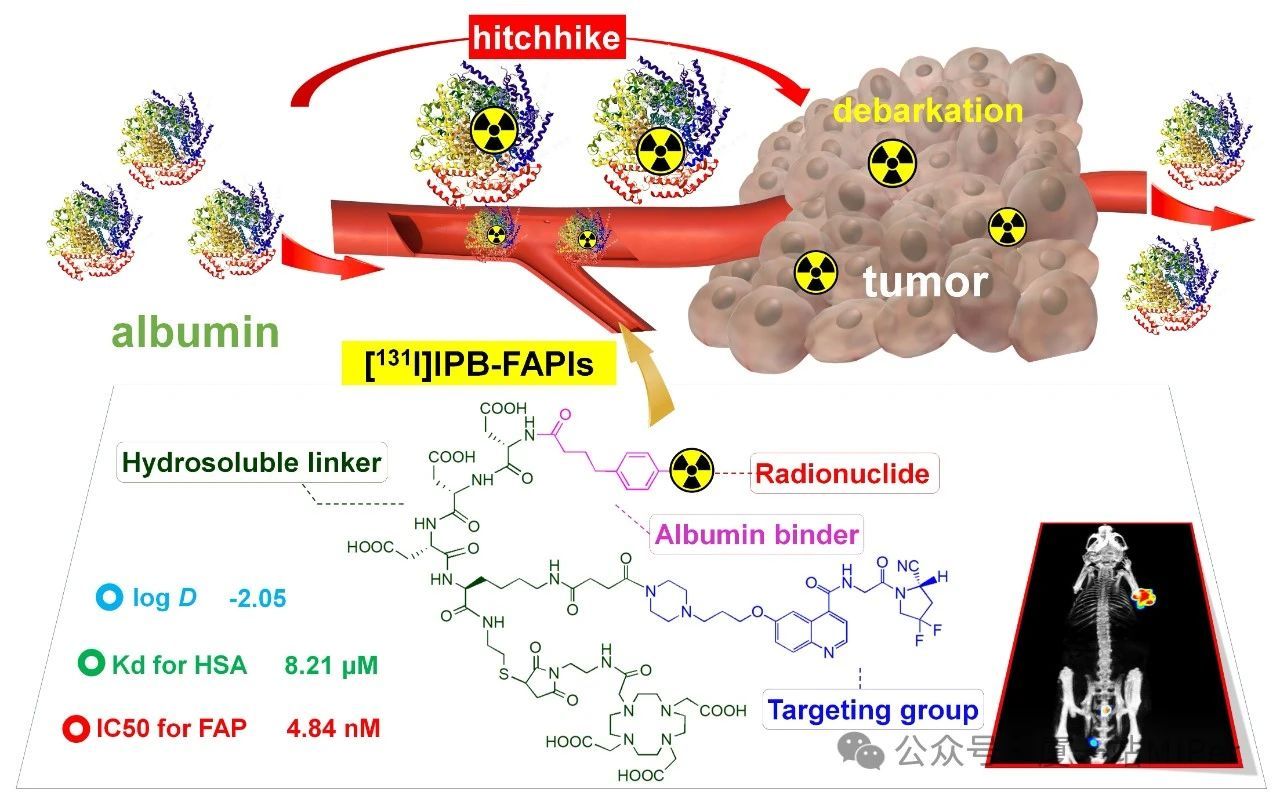
此外,在本月初,J Control Release期刊登了团队关于放射性碘标记FAP靶向探针的相关研究成果,为IPBA修饰探针工具箱再添新成员。成纤维激活蛋白(FAP)作为癌症相关成纤维细胞(CAFs)中具有代表性的生物标志物,在以组织重塑为特征的疾病损伤或者癌症中过表达,是非常有前景的诊疗靶点。而目前,血液清除快,肿瘤滞留相对不足等缺点阻碍了FAP靶向放射性探针在核医学领域的应用。因此如何改善放射性标记探针的药动学性质,提高肿瘤摄取,减少非靶器官滞留,成为该领域亟待解决的问题。放射性碘标记的IPBA-NHS可作为Bolton-Hunter试剂,无需额外螯合剂即可灵活构建FAP靶向放射性分子探针。IPBA这种兼具标记基团和白蛋白结合的功能,极大简化了FAP靶向放射性示踪剂的设计,为白蛋白-放射性药物工具箱的扩展提供了新思路。IPBA修饰的放射性探针的核心价值在于其可调控的药代动力学特性及承载核素的灵活性,未来需进一步探索其在临床诊疗中的合理应用。通过优化IPBA衍生物结构、验证人体适用性,并结合新型放射性核素,有望开发出更高效的肿瘤诊疗一体化方案,推动精准医疗发展。
课题组博士后方建阳,博士生孟令欣、张静茹,硕士生厉会峰、夏冬生、林晓茹等同学作为第一作者参与了以上成果的发表。相关成果得到国家自然科学基金、南强青年拔尖人才支持计划,福建省雏鹰计划的支持。
更多成果介绍,欢迎访问课题组公众号

文章链接:
https://www.sciencedirect.com/science/article/abs/pii/S0168365925003773
https://www.sciencedirect.com/science/article/abs/pii/S0168365925002986