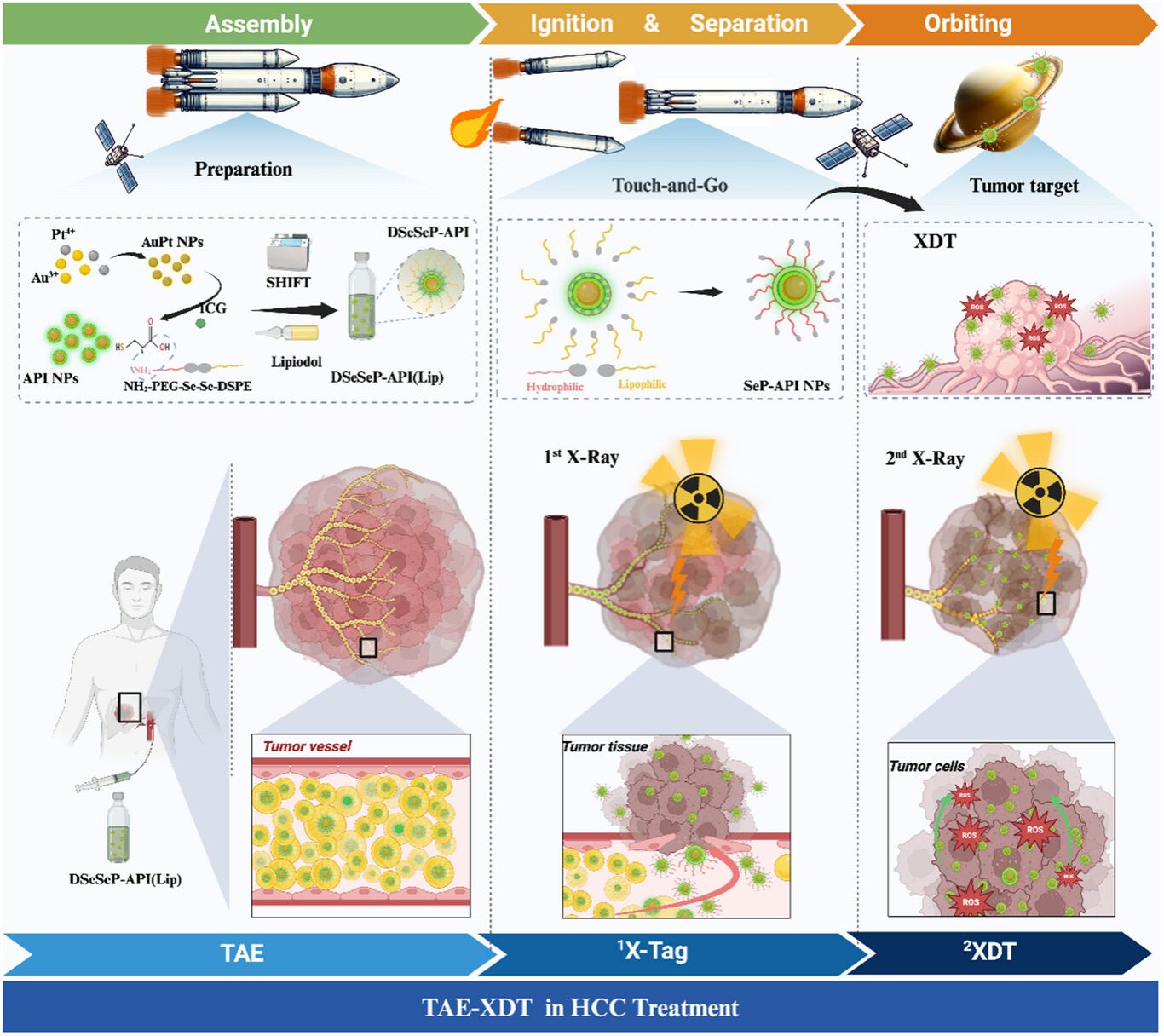
肝癌是全球癌症相关死亡的第三大杀手,约70%患者确诊时已处于中晚期,丧失手术机会。经导管动脉化疗栓塞术(TACE)联合放射治疗(RT)是临床治疗不可切除肝癌的主要方案,但传统化疗药物与放疗的协同效率低下,且存在脱靶毒性等瓶颈。厦门大学公共卫生学院刘刚教授联合医学院楚成超教授团队深耕肝癌精准治疗领域,在《Advanced Functional Materials》发表重要研究成果“X-Ray Triggered Phase SHIFT in Radiosensitizer-Lipiodol Formulation for Controlled Synergistic TAE−XDT Cancer Therapy”。团队研发的新型纳米放疗增敏药物碘油制剂(DSeSeP-API (Lip)),采用创新的X射线一触即发式相移策略(X-tag),以X射线诱导动态相移效应,首次实现栓塞治疗与精准增敏放疗的时空协同,为肝癌治疗提供全新范式。
核心技术:“3S”效应赋能,打造智能递送系统
1、相移触发,精准控释
团队设计的AuPtICG(API)纳米颗粒以X射线敏感的二硒键(Se-Se)连接药物分子,通过团队专利技术SHIFT(1S-SHIFT),实现纳米颗粒在碘油中的长期稳定存在(2S-Stability) 。当介入手术将碘油制剂精准输送至肿瘤部位后,首次X射线照射触发二硒键断裂,亲水性放疗增敏剂(SeP-API)从碘油相迅速析出、进入肿瘤组织水相(3S–phase Shift,相移)。药物的可控相移,实现了药物的精准定位和控释,提高了药物的利用度和安全性。
2、一体多能,协同增效
首次碘油中实现X射线照射触发药物释放,在肿瘤细胞对SeP-API的摄取达到峰值时,二次X射线照射(2X-XDT)激活高Z元素(Au/Pt)的物理剂量沉积效应与吲哚菁绿(ICG)的化学ROS生成机制,通过“物理增敏+化学杀伤”双重途径,显著增强肿瘤细胞凋亡,同时减少正常组织损伤。
3、三重验证,安全高效
在体外HepG2培养细胞二维模型和去细胞肝组织三维模型中,X射线触发后0.5小时即可观察到纳米颗粒中所含ICG荧光信号出现,证实一触即发相移过程的快速且可控。
小鼠皮下瘤模型验证了显著的API放疗增敏效果;大鼠原位肝癌模型进一步验证了DSeSeP-API(Lip)+X射线协同治疗相对单一疗法的有效性;同时,动物活体实验未发现明显毒性,显示了协同疗法和药物递送系统的安全性。
机制创新。通过CT成像与MRI动态监测,揭示碘油作为“能量池”协同纳米颗粒增强X射线沉积的独特机制,为放射增敏剂设计提供新思路。
临床价值:从“联合治疗”到“精准协同”的提升
相较于传统TACE-RT方案,该策略突破了三大瓶颈:
✅稳定性难题:SHIFT技术解决了水溶性药物在碘油中易析出的问题,制剂可稳定保存半年以上,实现药物-介入治疗协同的可行性;
✅精准控释:X射线作为“分子开关”,实现了治疗药物在时空上的精准释放,避免系统毒性;
✅协同效应最大化:通过两次X射线照射的时序设计,使放射增敏剂在肿瘤细胞内的富集与作用达到最优匹配,显著提升放疗疗效。
研究展望:开启TAE-XDT精准治疗新纪元
这项研究不仅构建了“卫星发射式”的智能递送系统(从碘油载体“火箭”分离出SeP-API“卫星”,精准进入肿瘤细胞“轨道”),更首次将X射线触发的相移概念引入肝癌联合治疗,为开发新型放射增敏剂载体提供了普适性策略。未来,团队将进一步优化“X-tag”时间窗口,探索其在肝转移癌等复杂场景中的应用,为更多癌症患者带来精准治疗新希望。
相关论文以“X-Ray Triggered Phase SHIFT in Radiosensitizer-Lipiodol Formulation for Controlled Synergistic TAE−XDT Cancer Therapy” 为题发表于Advanced Functional Materials。本研究得到国家重点研发计划、国家自然科学基金等项目资助。
参考文献:
Q. Dai, L. Wang, S. Shao, Z. Jia, S. F. A. Rizvi, X. Gao, M. Teng, H. Chen, E. Ren, C. Chu, G. Liu, X-Ray Triggered Phase SHIFT in Radiosensitizer-Lipiodol Formulation for Controlled Synergistic TAE−XDT Cancer Therapy. Adv. Funct. Mater. 2025, 2501159.
DOI: https://doi.org/10.1002/adfm.202501159