嗜神经伪狂犬病毒(PRV)是一类能够突破外周屏障并侵入中枢神经系统(CNS)的病原体,常导致严重的脑功能紊乱与神经疾病。从脊髓灰质炎病毒到新冠病毒(SARS-CoV-2),已有多种病毒被证实可通过改变脑微循环、诱发炎症和血管内皮损伤,进而引发脑卒中、脑炎及长期认知功能障碍。然而,受限于血脑屏障的屏蔽效应与脑血管网络的高度复杂性,如何在活体层面动态观测病毒感染过程中脑微循环的变化,一直是该领域基础研究与临床转化面临的重要挑战。传统单一成像技术因在分辨率、成像深度或时间维度上存在局限,难以系统捕捉“血流-血管-分子”之间的多层次关联,从而制约了对病毒神经致病机制的深入解析以及疫苗与靶向治疗策略的研发。
针对上述难题,赵庆亮研究团队基于前期工作基础(Research,2025;Journal of Translational Medicine,2025.),近日在国际权威学术期刊Advanced Science上在线发表题为“Multimodal Imaging Reveals Cerebral Microcirculation Dynamics and Mechanisms in Mouse Central Nervous System after Intranasal Infection with Recombinant Pseudorabies Virus”的研究论文。该研究团队利用EP0-sgRNA-hSPCas9基因编辑系统成功构建了重组双标记伪狂犬病毒(PRV Fa-mNG-Luc)(图1),并通过鼻腔感染途径建立了稳定可靠的小鼠CNS感染模型。在此基础上,团队提出了一种跨尺度多模态成像策略,实现了对感染前后脑血流动力学从整体到微观的多层次动态监测。借助该技术体系,团队在活体层面清晰揭示了病毒感染早期大脑背侧皮层出现短暂性血流增高(高灌注反应),随后逐渐下降,并在初级视觉皮层区域表现最为显著;感染后期则伴随血管异常扩张与结构重塑等关键病理改变。转录组测序分析进一步表明,PRV感染激活了机体免疫炎症反应,导致血管内皮功能受损及发育抑制。分子证据与影像学表型高度吻合,共同提示嗜神经病毒可能通过“血管内皮损伤—血管结构异常—血流动力学障碍”的级联反应加剧脑功能紊乱。
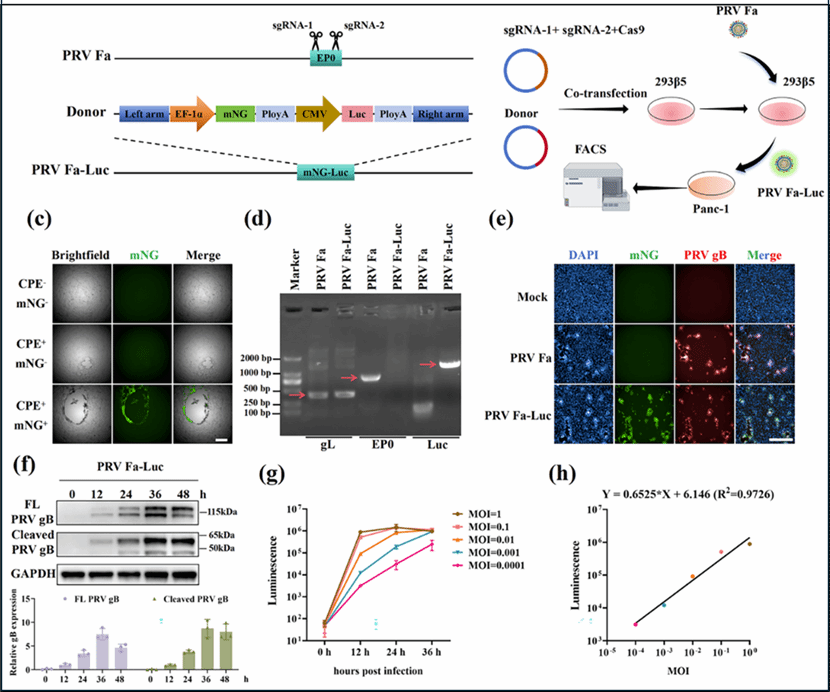
图1.重组PRV Fa-mNG-Luc的构建与鉴定
该研究首次系统阐释了PRV感染引发中枢微循环障碍的动态过程与分子机制,所建立的多模态成像策略不仅为深入理解嗜神经病毒的致病机制提供了有力工具,也为未来开发新型疫苗与靶向药物以及早期预警方法奠定了重要的理论与技术基础。
中心硕士研究生凌淑婷、疫苗中心博士研究生桂孟玹及吴崇鑫为该论文的共同第一作者。我院赵庆亮副教授、陈毅歆教授和王国松博士后为该论文的共同通讯作者。该工作得到了国家自然科学基金、翔安创新实验室/传染病疫苗研发全国重点实验室以及厦门大学校长基金等项目的资助。
论文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202508124